气管灌洗技术在犬呼吸道感染疾病诊治中的应用
犬的细菌性支气管炎/肺炎是非常常见的疾病,尤其常见于幼年犬。随着国内小动物医学的发展和抗生素的广泛应用,犬呼吸道感染细菌的耐药性日趋严重,为了解北京地区犬呼吸道感染病原菌的耐药性,我们对前来中国农业大学教学动物医院的呼吸道感染患犬进行气管灌洗,对灌洗液进行微生物培养和药敏试验,初步调查犬呼吸道源性细菌的耐药情况,为临床工作提供参考。
1. 材料和方法
1.1 病例来源
2014年1月至2015年5月期间来中国农业大学动物医院就诊的病例。进行气管灌洗的患犬均有严重的持续性呼吸道症状,X线检查提示严重肺炎;至少用过两种抗生素。记录患犬的年龄、品种、性别、临床表现、用药史等信息。
1.2 气管灌洗(气管内技术)
采用丙泊酚麻醉(3~ 5 mg/kg,IV),无菌操作,插入气管插管,经气管插管插入冲洗管(无菌导尿管);冲洗时注入少量生理盐水,然后迅速回抽。
1.3 细胞学检查
取少量气管冲洗液制作细胞学涂片(每个病例至少4张玻片),分别采用商品化瑞姬氏染液和革兰氏染液染色。
1.4 微生物培养和药敏试验
将采集到的新鲜样本迅速接种于血平板、麦康凯平板和SDA平板,24小时、48小时和72小时各查看一次结果,根据菌落大小选择合适的时间进行药敏试验(药敏试验平板选择原则:普通细菌采用MHA平板,苛养菌采用血平板)。
1.5 数据统计分析
白细胞计数采用描述统计,以平均值标±标准差的形式显示。
2. 结果
2.1 年龄分布
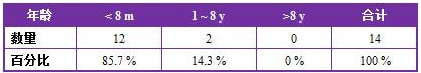
14例患犬中,2例为成年犬(2岁),其他均为幼龄犬(2月龄至8月龄)(见表1)。
表1 14例细菌性呼吸道感染患犬的年龄分布
2.2 临床表现
所有患犬均表现为较为严重的呼吸道症状,持续性咳嗽、脓性鼻分泌物、气喘、腹式呼吸甚至呼吸困难;同时伴有食欲下降、精神不振等症状,还有2例有发烧的表现。
2.3 实验室检查结果
2.3.1全血细胞计数(CBC)
所有患犬均进行了全血细胞计数(CBC),患病初期白细胞水平处于参考范围内([14.87±2.97]×109/L,n=14),随着病情发展,白细胞显著升高,最高点白细胞达([29.04±10.13]×109/L,n=9),康复患犬的WBC最终回到参考范围内([12.56±1.93]×109/L,n=7)。
2.3.2 细胞学检查
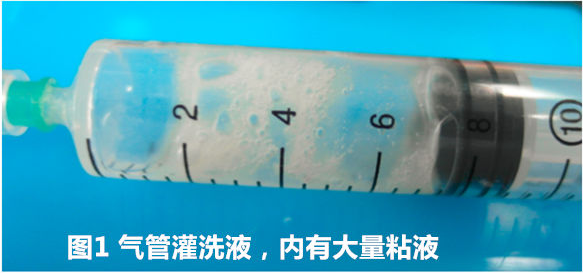
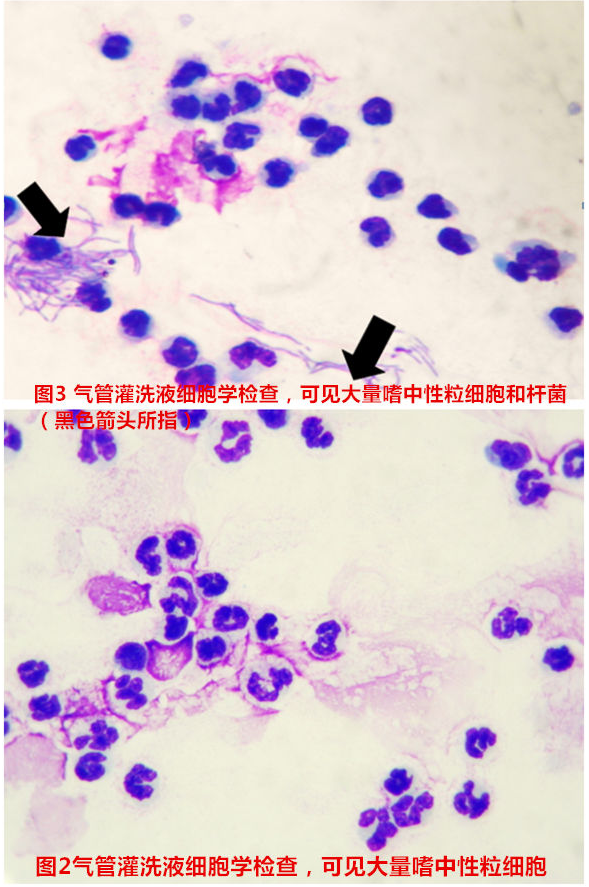
所有气管灌洗液(图1)均进行了细胞学检查,所有病例细胞学检查均可见大量嗜中性粒细胞(图2),仅有3例病例的气管灌洗液中可见到大量细菌(图3),2例病例的冲洗液中可见到少量纤毛上皮。
2.3.3 微生物检查
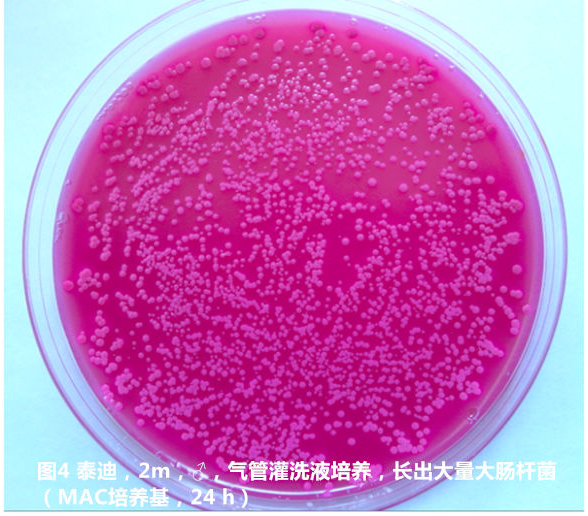
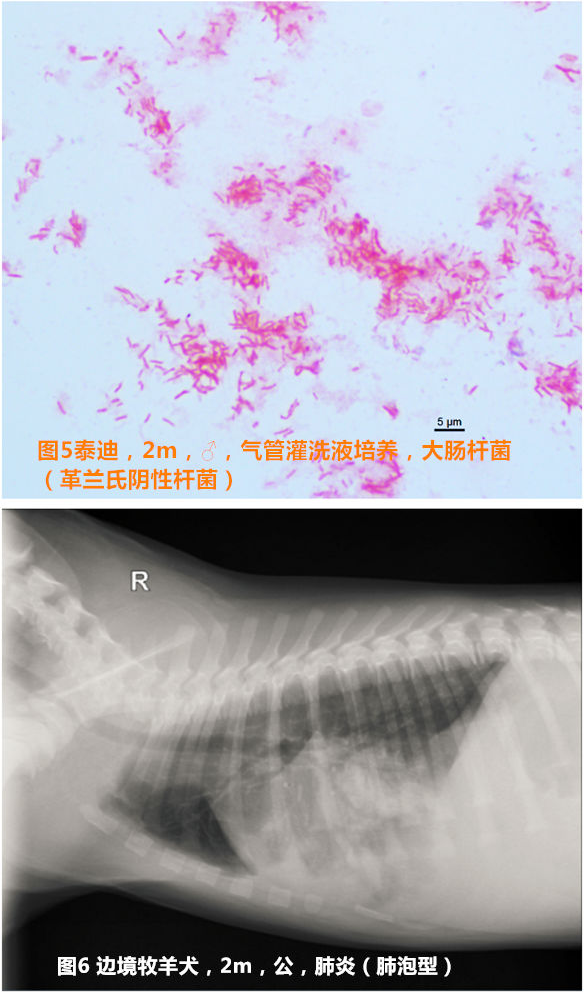
14例患犬的气管灌洗液经培养后,仅有1例阴性其他13例(92.9 %)均为阳性,其中一例合并酵母菌感染和细菌感染。50 %(7例)的患犬仅培养出一种细菌,35.7 %的患犬培养出两种细菌,还有14.3 %的患犬培养出3种细菌(见图4和图5)。
药敏试验结果显示,革兰氏阴性菌的耐药性非常强,从100 %(克林霉素)到18.7 %不等,4株细菌同时做了美罗培南和亚胺培南,均对两种药物敏感(详见表2);多重耐药的现象也非常严重,3株细菌仅对美罗培南、亚胺培南敏感;1株细菌仅对美罗培南、亚胺培南和氯霉素敏感。由于菌株数量较少,未进行菌种鉴定和耐药谱分析。
表2 16株革兰氏阴性细菌药敏试验结果
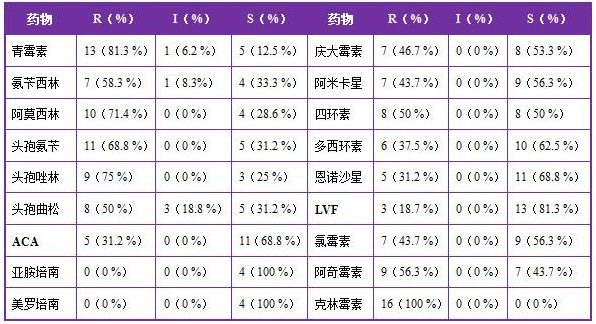
注: ACA代表阿莫西林克拉维酸;LVF代表左氧氟沙星。
2.4 影像学检查结果
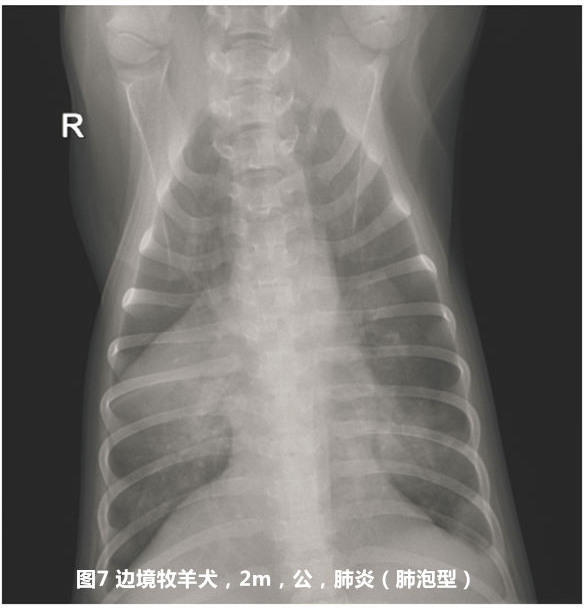
胸部X线平片检查显示,14例患犬均有严重的肺炎征象(见图6和图7)。50 %以上的病例呈肺泡型,21.4 %的病例表现为大叶性肺炎。
2.5 治疗方案及治疗效果
进行气管灌洗的患犬根据药敏试验结果选择合适的抗生素治疗,并辅以营养支持。14例患犬中,7例(50 %)康复,4例(28.6 %)死亡,3例跟踪失败。
分离菌株仅对美罗培南和亚胺培南敏感的3例患犬中,1例康复,1例自然死亡,1例治疗过程中发展为腹水,最终被安乐;康复的病例中,多数在更换抗生素后三天左右症状好转,连续用药一周左右症状消失。
3. 讨论
呼吸道感染的致病原有很多种,包括细菌、真菌、病毒和寄生虫等[1-3]。病毒一般不直接引起严重的肺炎,继发细菌感染后才会表现出明显的临床症状[2-4]。感染性肺炎常见于免疫不全或有免疫抑制的幼年动物[4, 5],因此,犬瘟诱发的肺炎在国内非常常见。一项调查显示,犬的急性呼吸道感染病例中,37.8 %的患犬副流感病毒阳性[4]。因此,在犬的细菌性呼吸道感染的诊断中,病因调查非常重要,但需要更多的实验室检查(尤其是分子生物学检查)诊断。本次调查中,85.7 %的患犬为幼龄犬,未免疫完全,一例2月龄边境牧羊犬经PCR检查和其他检查诊断为犬瘟热,后继发为严重的细菌性肺炎。其他病例CDV抗原检查均为阴性,但未进行其他呼吸道病毒(如流感病毒、副流感病毒和腺病毒Ⅱ型)的抗原检查,无法确细菌感染是否为继发的,诊断水平急需进一步提高。
细菌性肺炎患犬的白细胞可能会明显升高,且有可能出现核左移[6]。本次调查发现,14例患犬在严重肺炎期间,出现了以嗜中性粒细胞和单核细胞升高为特征的白细胞增多症。气管灌洗培养进一步佐证了感染引起了局部严重的化脓性炎症,组织吞噬需求增多,最终导致外周血单核细胞增多。2例患犬白细胞升高伴显著核左移,可能是由于肺部炎症消耗过多白细胞,超过骨髓生成速度导致的。
气管灌洗是一项重要的实验室检查技术,可以避免口腔或鼻腔正常菌群的污染,获得较为准确的数据[3]。这一操作要求较高,需在已经获得病史、体格检查、胸部X线片及其他常规指标后进行。本次调查的患犬均进行了较为全面的检查,做了全面的麻前评估,最后采取气管内技术进行气管灌洗,冲洗液迅速送至检验科进行细胞学检查和微生物培养。
气管灌洗液检查中,细胞学检查非常重要,可以从细胞的种类和数量鉴别化脓性炎症、肉芽肿性炎症、肿瘤等[7]。本次调查中,所有病例气管灌洗液细胞学检查均可见大量嗜中性粒细胞(> 80 %),且多呈退行性变化,巨噬细胞所占比例不足10 %,这些表现提示化脓性炎症反应,不管有无肉眼可见的细菌,均怀疑细菌感染,需进行微生物培养。本次调查中,仅有3例患犬细胞学检查时发现有细菌,阴性检查结果可能跟灌洗液中有大量黏液有关,这些黏液含有蛋白样物质,它们能使细胞成团,干扰细胞形态学的判读。细胞学检查在微生物检查方面也有很多自身的局限性,因此,不能仅靠细胞学评估是否为感染。
本次调查中,13例(92.8 %)患犬的气管灌洗液细菌培养阳性。结合细胞学检查结果,再次提示微生物培养是诊断的关键,敏感性远远高于细胞学检查。培养呈阴性的患犬一直在应用抗生素,因此,单次培养并不能排除细菌感染。细菌性肺炎犬、猫中,最常分离出的细菌包括巴斯德菌、克雷伯氏菌、大肠杆菌、假单胞菌、葡萄球菌、链球菌和博德特氏菌等[1, 2, 4]。文献显示,博德特氏菌是一种球杆菌,常和犬呼吸道感染综合征或窝咳有关[4, 5]。本次调查样本量也不够大,研究不够深入,尚未进行细菌种属鉴定,无法了解是否有博德特氏菌感染,以后需深入调查,提高认识水平。
近年来,随着抗生素的广泛应用,宠物源性细菌的耐药性越来越广泛,尤其是革兰氏阴性杆菌[3]。本次调查中,16株分离到的革兰氏阴性杆菌表现出严重的耐药性,多数菌株对青霉素类、头孢菌素类、氨基糖胺类、四环素类、氟喹诺酮类抗生素均表现出不同程度的耐药性,对碳青霉烯类、β内酰胺酶抑制剂有较高的敏感率,甚至有3株细菌仅对碳青霉烯类敏感。这一结果提示,北京地区犬呼吸道源性细菌的耐药性非常强,这和患犬病程较长、用过多种抗生素一定关系,但环境中的耐药菌也可能是感染的重要来源。
本次调查的病例均根据药敏试验结果更换了合适的抗生素,结果显示50 %的病例康复, 28.6 %的病例死亡,还有22.4 %的病例跟踪失败。康复病例多于更换药物3天左右明显好转,一周左右康复,大大缩短了治疗时间;死亡病例直接死于肺炎,或因严重肺炎被安乐。值得注意的是,分离菌株仅对碳青霉烯类敏感的3个病例中,仅有1例康复,另外2例均死亡。
综上所述,对犬呼吸道感染来说,气管灌洗和微生物培养是非常好的诊断手段,微生物培养的敏感性远远高于细胞学检查,药敏试验结果可用于指导临床用药,缩短治疗时间。然而,本次调查还发现北京地区犬呼吸道源性细菌耐药性很强,多重耐药现象已经是常态,临床兽医若不进行气管灌洗和微生物培养,已经无法经验性选择何种抗生素来进行治疗。这一现象分表明,抗生素应用已经成为兽医临床面临的重大挑战,科学合理应用抗生素,已经成为临床兽医的一种职责。
致谢:中国农业大学动物医院影像科提供了大量影像学诊断的帮助,在此深表感谢。
主要参考文献
[1] Ellis J A. How well do vaccines forBordetella bronchiseptica work in dogs? A critical review of the literature1977-2014. Vet J, 2015,204(1):5-16.
[2] Nelson R W, Couto C G. Small animalinternal medicine. Fifth edition. 2014.
[3] Nelson R W, Couto C G. Small animalinternal medicine. 4th ed. St. Louis, Mo.: Mosby/Elsevier, 2009.
[4] Schulz B S, Kurz S, Weber K, et al.Detection of respiratory viruses and Bordetella bronchiseptica in dogs withacute respiratory tract infections. Vet J, 2014,201(3):365-369.
[5] Canine and Feline InfectiousDiseases. 2013.
[6] Dial S M, Rosenfeld A J.Clinical pathology for the veterinary team. Ames, Iowa: Wiley-Blackwell, 2010.
[7] Cowell and Tyler's Diagnostic Cytology andHematology of the Dog and Cat. 2013.