犬猫白细胞遗传性疾病之Pelger - Huët异常
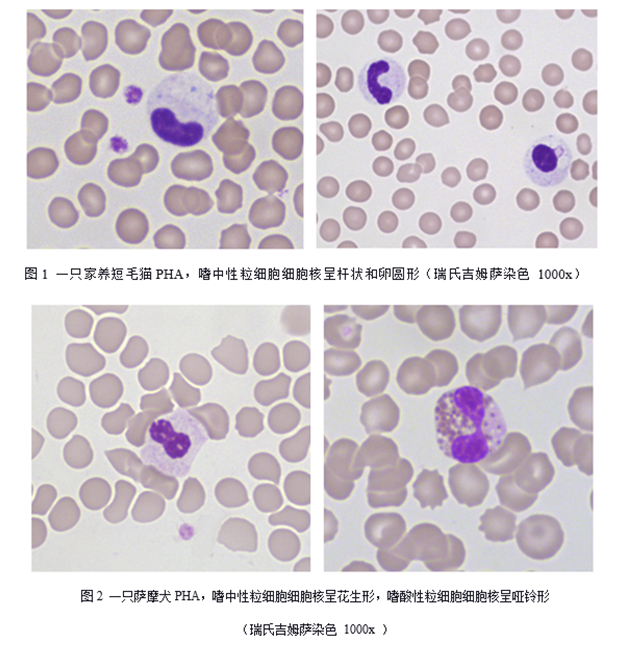
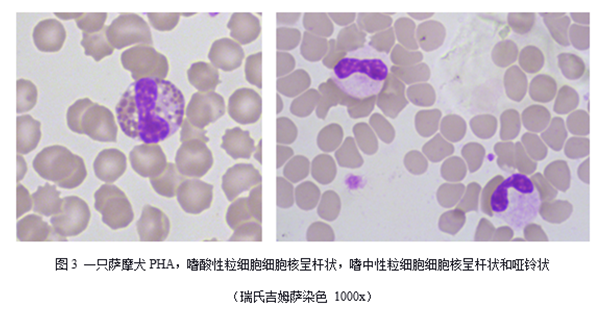
Pelger - Huët异常(PHA)是犬、猫、马、兔、鼠和人均可见的一种遗传病,其特征是成熟白细胞的细胞核出现未分叶或低分叶现象,细胞核呈圆形、卵圆形、哑铃形、花生形、两叶形或杆状形(见图1、图2和图3),细胞核染色质粗糙致密[1,2]。该遗传病属于常染色体显性遗传,形成原因是由编码核纤层蛋白B受体(LBR)的基因突变导致,而白细胞细胞核分叶与核纤层蛋白有关[3]。
目前有文献报道患这种遗传病的犬品种包括可卡犬、巴辛吉犬、边境牧羊犬、英国和美国猎狐犬、萨摩耶犬、澳洲牧羊犬、澳洲牧牛犬、波士顿梗犬、德国牧羊犬、猎浣熊猎犬和杂种犬[4]。虽然这种遗传病罕见,但是对于某些品种如澳洲牧羊犬更常见,发病率为9.8%[5]。
患病动物通常不表现出临床症状,因此容易被忽略,实验室检查偶然发现[6]。血涂片中可见嗜中性粒细胞、淋巴细胞、单核细胞、嗜酸性粒细胞和嗜碱性粒细胞的细胞核未分叶现象。PHA白细胞与正常成熟白细胞相比,细胞大小和细胞质相似,细胞核形态不同,PHA细胞核形态多样,可见圆形、卵圆形、杆状、哑铃状或花生状细胞核,杆状细胞核比正常要更短更厚。细胞核染色质成熟、粗糙和致密成簇。与晚幼和中幼粒细胞相比,PHA的白细胞细胞核更小,核染色质更致密[7]。
PHA的白细胞趋化性、黏附作用、吞噬作用、颗粒成分和寿命等与正常成熟白细胞没有区别[7]。临床需与骨髓发育不良和骨髓增生性疾病相区别,实验室检查、临床表现和家族史有助于鉴别诊断。血涂片检查注意观察细胞核分叶、细胞核大小、细胞核染色质和胞浆颗粒。
此外,临床还需要与获得性或伪PHA相鉴别,这种情况在人医研究较多,主要是由化学物质、血液疾病和非血液疾病继发引起。化学物质主要包括磺胺异恶唑、苯、布洛芬、骨髓抑制药、磺胺类药物、美法仑、免疫抑制剂、氟康唑、丙戊酸和紫杉醇等;血液疾病包括:骨髓增生异常综合征、红细胞增多症、霍奇金病、多发性骨髓瘤、慢性髓细胞白血病、类白血病反应、骨髓纤维化、粒细胞增多症和巨幼红细胞性贫血等。
非血液病包括:疟疾、红斑狼疮、流行性感冒、肠炎、支原体性肺炎、肌肉营养障碍性疾病和艾滋病等[7]。获得性或伪PHA的血涂片中白细胞大多数分单叶和两叶,有少量分三叶核(<10%),很少存在有分四叶核的白细胞[8]。特别注意细胞质中是否出现中毒性颗粒、空泡化和杜勒小体,细胞核染色质、细胞核大小和核分叶形态都有助于鉴别诊断。伪PHA的细胞核较苍白、轮廓不清、核染色质不成簇、核叶呈椭圆形,分叶数不等[9]。在血涂片观察中,表1列出了PHA中白细胞细胞核与其他易误认为是PHA的白细胞细胞核进行了比较,有助于临床检验参考。
总结
PHA与健康动物体征无异,不会增加严重感染的风险,无需治疗[10]。PHA属于良性先天性血液学疾病,临床需要与败血症、骨髓增生异常综合征和一些白血病相区别,主要通过临床症状、实验室检查和家族史进行诊断,血涂片主要观察白细胞细胞核大小、形态、核染色质成熟程度和细胞质变化进行鉴别诊断。

感谢:本文所有图片均由中国农业大学动物医院检验科提供
参考文献
1. Grondin TM, DeWitt SF, Keeton KS. Pelger - Huët anomaly in an Arabian horse. Vet Clin Pathol 2007 ; 36 : 306 – 310.
2. Latimer KS: 2006, Pelger-Huët anomaly. In: Schalm’s veterinary hematology, ed. Feldman BF, Zinkl JG, Jain NC, 5th ed., pp. 976–983. Blackwell, Ames, IA.
3. Shultz LD, Lyons BL, Burzenski LM, et al. Mutations at the mouse ichthyosis locus are within the lamin B receptor gene: a single gene model for human Pelger - Huët anomaly . Hum Mol Genet 2003 ; 12 : 61 – 69.
4. André M. Vale, Klívio Loreno R. Tomaz, et al. Pelger-Huët anomaly in two related mixed-breed dogs. Journal of Veterinary Diagnostic Investigation 23(4) 863–865.
5. Latimer KS, Campagnoli RP, Danilenko DM: 2000, PelgerHuët anomaly in Australian shepherds: 87 cases (1991–1997). Comp Haematol Int 10:9–13.
6. M.M. Speeckaert, C. Verhelst, et al. Pelger-Huët Anomaly: A Critical Review of the Literature. Acta Haematol 2009;121:202–206.
7. Constantino BT: Pelger-Huët anomaly – morphology, mechanism, and significance in the peripheral blood film. Lab Med 2005; 36:103–107.
8. Davidson WM, Lawler SD, Ackerley AG: The Pelger-Huët anomaly: investigation of family A. Ann Hum Genet 1954;19:1–9.
9. Skendzel LP, Hoffman GC: The Pelger anomaly of leukocytes: forty-one cases in sevenfamilies. Am J Clin Pathol 1962;37:294–301.
10. Cunningham I, MacCallum SJ, Nicholls MD, Byth K, Hewson JW, Arnold B, Motum PI, Mulligan SP, Crane GG: The myelodysplastic syndromes: an analysis of prognostic factors in 226 cases from a single institution. Br J Haematol
1995;90:602–606.
11. Rita Colella, Sandra C. Hollensead. Understanding and Recognizing the Pelger-Huët Anomaly. Am J Clin Pathol 2012;137:358-366