
肝脑症
病因及致病机制
肝脑症(hepatic encephalopathy)为动物的大脑皮质接触过多由小肠吸收但未被肝脏代谢去除之毒素,而出现异常心智及神经功能的一种疾病,可能的发生原因为肝脏组织受损或肝门脉血流出现分流情形,使胃肠道吸收之毒素无法有效被去除所导致。目前被认为会导致肝脑症发生的物质包括氨(ammonia)、硫醇(mercaptans)、短链脂肪酸(short-chain fatty acids)、粪臭素(skatoles)、吲哚(indoles)、及芳香族胺基酸(aromatic amino acids),其中血液氨浓度为最重要引起肝脑症之因素。大脑对于氨的毒性非常敏感,但因大脑缺乏尿素循环,因此氨在脑脊髓液是代谢成谷氨酰胺(glutamine),在患有肝门脉系统分流的犬其脑脊髓液中之谷氨酰胺浓度与临床症状的相关性高于与脑脊髓液或血液氨浓度。患有先天性门脉系统分流之狗也可发现脑脊髓液中之芳香族胺基酸,尤其是色氨酸(tryptophan)及其代谢物的浓度增加,且与脑脊髓液中的氨浓度有直接相关,因两者具有共同的反向运输蛋白(antiport transporter),除此之外中枢神经系统也出现血清素活性改变(通常为降低);刺激NMDA受体、周边型benzodiazepine受体及星状细胞受体,大部分上述的变化皆与氨增加有关。
患有肝脏疾病的动物其血液氨浓度增加的来源包含以下:未消化的胺基酸及嘌呤抵达结肠后被肠道细菌分解;由血中扩散至结肠的尿素被细菌或肠道的尿素酶作用;小肠细胞代谢谷氨酰胺作为其能量来源;肝脏代谢过多的饮食蛋白、肠胃道出血或分解瘦体组织产生之内源性蛋白(图1)。传统看法认为饮食而产生之毒素为造成肝脑症之主要来源,虽然高蛋白饮食的确是一个相当重要的氨来源,但在许多动物,尤其是具有蛋白质热量营养不良症,内源性氨相较来说更重要。
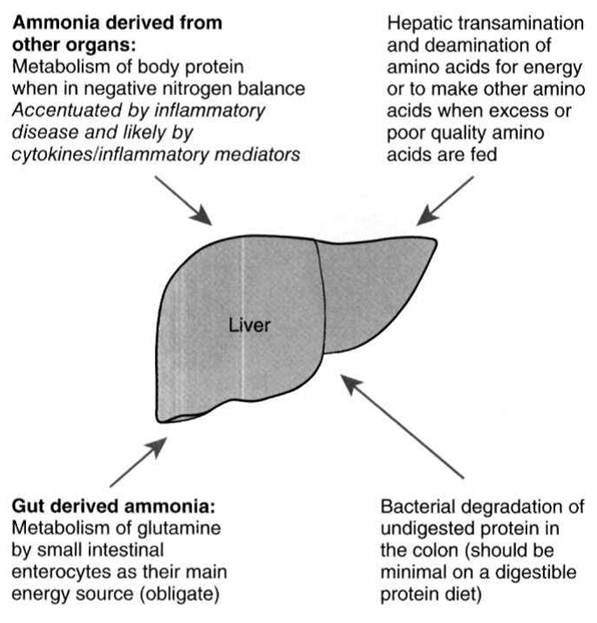
图1、导致肝脑症的可能氨来源,目前普遍认为结肠代谢未消化蛋白质所产生的氨为最不重要
临床症状
慢性或亚临床症状包括食欲不振、精神沉郁、体重减轻、昏睡、恶心、发热、过度流涎(尤其在猫)、间歇性呕吐及下痢。某些情形可能会造成急性的肝脑症发作伴随严重的神经症状,较典型的神经症状通常为非局部性,包括颤抖(trembling)、共济失调(ataxia)、歇斯底里(hysteria)、痴呆(dementia)、明显地行为改变(通常倾向侵略性)、绕圈子(circling)、头部压迫(headpressing)(图2)、皮质盲(cortical blindness)及癫痫发作(seizures)。偶尔具有高氨血症的动物在经过适当治疗肝脑症后,会出现非对称性、局部性神经症状。

图2、患有肝脑症的犬可见出现典型头部压迫(head pressing)神经症状。
诊断
肝脑症主要根据出现相似的临床症状、排除脑病变的其他病因、实验室检查结果、影像检查和对治疗的反应来诊断。若症状于饭后会变严重,通常为肝脑症的机率很高。实验室检查如全血细胞计数、血清生化、及尿检可提供有用的信息,例如先天性肝门脉系统分流患犬常出现小红血球增多症(microcytosis)、低白蛋白血症、高胆固醇血症及低血清尿素及葡萄糖浓度。后天性肝门脉系统分流患犬出现肝脏酵素活性增加及肝衰竭征兆,如高胆红素血症及低白蛋白血症。血浆氨浓度在肝脑症患犬或患猫通常会增加但也可能正常,尽管禁食氨浓度很难预测肝脑症的严重程度,但仍建议进行检测以评估犬及猫是否可能患有潜在肝脑症。有其他因代谢而造成神经症状的疾病,如尿毒症和低血糖症,也可透过血清生化检查及尿液学检查来排除。
肝门脉系统分流为常见造成肝脑症的原因,需评估患病的可能性。血浆氨浓度检测对于诊断肝门脉系统分流敏感性极高,通常,高氨血症即显示有肝门脉系统分流或肝功能不全,虽然尿素循环酶缺乏的动物也可能出现高氨血症。检测饭前及饭后血清胆酸浓度对于诊断肝胆疾病相当有用,其中也包含肝门脉系统分流,而最终诊断需藉由影像学检查或手术进行确诊,可利用以下几种成像方式:血管造影,腹部超音波检查,肝门静脉扫描(portal scintigraphy),计算机断层扫描血管造影和核磁共振成像血管造影来帮助诊断。
治疗
治疗肝脑症的目标为藉由降低肠道来源及周边来源之脑毒素、去除促发因子及修正酸硷平衡及电解质异常来恢复正常的神经功能,会造成肝脑症之脑毒素很多,以治疗的观点来说最重要的为氨。长期治疗慢性肝脑症的标准策略为结合饮食控制、预防产生易吸收的氨、使用局部作用剂加强肠道排空、抗生素抑制会制造氨及其它脑毒素的细菌、及针对任何促发因子做控制。无论犬猫是因先天性或后天性(主要为犬)肝门脉系统分流而引起肝脑症,治疗策略皆差不多,主要的不同点在于后天性肝门脉系统分流通常源自门脉高压,因此针对潜在的肝脏疾病治疗也相当重要。在动物尚未执行足够多的试验以确定肝脑症各期(轻微、中等、严重)的最佳治疗方式,因此目前的治疗建议是根据人医的研究及犬猫个案病例所制定。
针对肝脑症理想的饮食管理与患有慢性肝脏疾病的犬之建议饮食相同。蛋白质限制的饮食长久以来被推荐使用于肝脑症病患,原因为未消化之蛋白质于肠道被细菌分解为氨,然而根据最近被提出的说法,肠道细菌只会代谢已到达结肠之未消化蛋白质,若饮食中蛋白质易消化且未达过量至超过小肠的代谢能力,应不会发生上述现象。肝门脉循环具有高的氨浓度,由其是餐后,但最主要的来源为谷氨酰胺被小肠肠细胞代谢以作为主要能量来源,而小肠谷氨酰胺酶(glutaminase)活性似乎在患有肝硬化的病患会增加,进而增加肠道氨制造,原因不明。在实验犬的研究肝门脉系统分流及患有后天性门脉系统分流之动物及人,所需蛋白质摄取量皆高于正常的犬及人,因此目前的建议为给予患有先天性或后天性肝门脉系统分流正常至轻微减少蛋白质含量且易消化、具高生物价的食物,以减少未消化蛋白质抵达结肠。有些专家推荐饮食需含有低量的芳香族胺基酸,因其会导致肝脑症,但事实上并无证据显示饮食中芳香族胺基酸与支链胺基酸比例对于肝脑症有影响。食物需以少量给予且通常避免超过肝脏代谢的能力。针对患有肝脏疾病的狗所研发的产品为好的选择,但相对来说对蛋白质有限制,因此需额外提供高质量的蛋白质例如奶酪或鸡肉。替代的方式为针对肠道疾病设计的饮食,含有高质量、高度易消化蛋白质来源。多数患有先天性或后天性肝门脉系统分流的犬可耐受正常蛋白质摄取量,少部分短期需要更多限制,但长期应尽力增加含量至恢复正常蛋白质摄取量。
乳果糖(lactulose)为一半合成双糖,不会被哺乳动物消化,因此会抵达结肠而被细菌降解为短链脂肪酸,这些短链脂肪酸可藉由酸化肠道内容物、将氨离子滞留于结肠中、及促进渗透型下痢,来帮助控制肝脑症的症状。此外短链脂肪酸可被结肠细菌利用作为能量来源,促进其生长并使结肠的氨与他们的蛋白结合,之后一起随粪便排出。剂量为猫口服给予2.5至5毫升,一日三次;犬为口服给予2.5至15毫升,一日三次。一开始给予较少的剂量,持续调整直至当动物每日排出2至3次软便,注意剂量过高会导致水痢。长期使用除了下痢外,尚无发现会导致其他并发症,然而使用于肝脑症患犬及患猫的效力从未被评估过,而最近在人的研究则指出并非当初所预期的如此有帮助。乳果糖也可以灌肠剂的方式给予,因许多犬及猫对于乳果糖的甜味强烈地排斥,也可使用乳糖醇(lactitol)做为替代品,以粉末的形式给予。
若饮食疗法单独或与乳果糖合并使用仍无法控制肝脑症,则需考虑其他药物。抗厌氧菌之抗生素(如metronidazole、amoxicillin)为首选。抗格兰氏阴性、会分解尿素的菌种的抗生素(如neomycin)也可使用,但neomycin较适合用于急性肝脑症,长期使用会使肠道细菌出现抗药性,此外neomycin会滞留于肠道,不易吸收至全身,而长期治疗较适合使用易吸收之抗生素以预防菌血症。某些因子已知会促发或加重肝脑症,需预防或有效处理,事实上,许多病例这些促发因子相较于饮食更加重要。在感受性高之动物,即使轻微感染如膀胱炎或耳朵疾病也可导致肝脑症发作,因此特别注意要迅速发现及处理任何并发的炎症反应。
针对急性肝脑症发作,禁食、给予灌肠剂及静脉输液为标准医疗策略。温水灌肠清洁可清除结肠内容物及预防吸收肠道毒素,乳果糖或稀醋可被添加以酸化结肠及降低吸收氨。最有效的灌肠剂包含30%乳果糖及70%水,总剂量为每公斤20毫升,持续灌肠15至20分钟,可每4至6小时给予一次,为了使乳果糖有效,pH值需维持于6或更低,需密切注意输液量避免灌肠过于剧烈而导致脱水。选择输液应避免含有乳酸,会转换为碳酸氢盐,pH增加促进形成更容易扩散形式的氨,使肝脑症更严重。0.45%生理盐水含2.5%葡萄糖为一好的选择,可根据血清浓度决定是否添加钾。癫痫发作的犬可使用低剂量的propofol或phenobarbital输液来稳定,有时需维持输液数小时至数天,但速度可逐渐降低,一方面控制癫痫发作,同时仍允许犬恢复意识,某些病例甚至可开始进食。尽管有一些早期的文献报告,目前还没有令人信服的证据证明肝脑症的其他药物治疗方法,因此除了抗生素和乳果糖外,目前并不推荐其他药物使用。
参考文献
1.Lidbury JA, Cook AK, Steiner JM. Hepatic encephalopathy in dogs and cats Vet
Emerg Crit Car 26: 471–487, 2016.
2.Morita T, Mizutani Y, Michimae Y, Sawada M, Sato K, Hikasa Y, Shimada A.
Severe involvement of cerebral neopallidum in a dog with hepatic encephalopathy.
Vet Pathol 41: 442-445, 2004.
3.Salgado M, Cortes Y. Hepatic encephalopathy: diagnosis and treatment.
Compendium. 35: E1–9; quiz E10, 2013.
4.Tivers MS, Handel I, Gow AG, Lipscomb VJ, Jalan R, Mellanby RJ. Hyperammonemia
and systemic inflammatory response syndrome predicts presence of hepatic
encephalopathy in dogs with congenital portosystemic shunts. PLoS One 9: e82303,
2014.
5.Watson PJ, Bunch SE. Hepatobiliary and exocrine pancreatic disorders. In:
Nelson RW, Couto CG, eds. Small animal internal medicine. 4th ed. Elsevier
Saunders, St. Louis, USA, 485-495, 2009.